复杂冠脉病变精准介入手术四注意
2014/01/13
近年心血管病尤其冠心病流行日益严峻,有效预防发病、延缓病情进展和救治复杂冠脉病变成为亟待攻克的临床壁垒。如今,经皮冠脉介入治疗(PCI)跃然成为冠状动脉粥样硬化性病变的一线治疗选择。而且,随着术者操作技巧与介入设备的日益改进,以往被视为介入治疗禁区的左主干病变、慢性完全闭塞病变(CTO)、三支病变和分叉病变等复杂冠脉病变逐渐向PCI敞开怀抱。人们欣喜地看到它正在或还将经历一次次蜕变,一次次超越自我局限,一次次将不可能变为可能。但要实现精准介入治疗,还需解决以下四个问题。
1. STEMI合并多支血管病变:优选一次还是分次策略?
临床医生常遇到冠脉造影提示≥两支冠脉狭窄超过50%或左主干病变患者,优选一次还是多次策略,现仍存争议。
同时处理非梗死相关血管对供血区心肌的潜在威胁,高致栓状态、手术复杂性、手术时间延长及术后90d死亡率增加等桎梏令介入医生却步:北美介入医生的一次干预比例为12.6%,西欧、东欧、澳大利亚/新西兰依次为10.5%、6.6%和6.1%,中国的数据不得而知。治疗药物/介入器械研发、实践经验积累和广泛采用经桡动脉径路或能改观这一现状。2013年发布的PRAMI研究,对465例无休克伴多支病变的ST段抬高型心肌梗死(STEMI)患者平均随访2.3年,佐证了完全血运重建策略的合理性(N Engl J Med.2013,369:1115)。 同年,对合并休克和心脏骤停复苏患者行直接 PCI 的研究为一次策略可改善临床结局提供初步证据:更完全的血运重建可提高6个月生存率;持续休克患者可考虑一次处理其他病变,决策主要取决于非梗死相关病变的复杂性和供血范围(JACC Cardiovasc Interv.2013,6:115)。
2013年ACCF/AHA STEMI诊治指南建议:病情稳定患者,不鼓励实施直接PCI同时处理非梗死相关血管;心脏泵衰竭所致心原性休克患者,直接PCI同时处理严重狭窄的较大非梗死相关血管,或有助于改善血液动力学障碍。对于该问题,阜外心血管病医院颜红兵教授认为:
☆ 大部分反对一次PCI策略者多依据间接或回顾性证据,局限性显而易见。指南仅是确定一个标准,并非“清规戒律”。
☆ 不应将文献报告一次PCI策略的高死亡率简单归咎于非梗死相关血管干预本身,或许为术中未评估某些相关因素所致。缺乏随机证据的情况下,一次或分次PCI策略孰优孰劣尚无定论。
☆ 经冠脉造影评估整个冠脉解剖后确定需处理病变,尽可能检测血流储备分数(FFR),有助术者明确分次PCI所要干预病变;除伴心原性休克患者,多数证据倾向分次PCI策略,术者认为必要时也可选择一次PCI策略。
☆ 可靠抗栓治疗和非复杂冠脉病变前提下,两种情况可选一次PCI策略:造影提示多支梗死相关血管可能;心原性休克患者存在多处非梗死相关血管严重狭窄。
2. 慢性完全闭塞病变:介入治疗成功要素有哪些?
CTO病变介入手术成功往往取决于天时、地利、人和。天时即指现有强支撑力指引导管、专用导引导丝、特殊器械和血管内超声(IVUS)等技术保障;地利包括病变时程、闭塞端形态、闭塞段长度、闭塞近端血管迂曲度、有无钙化、有无侧支血管等;人和涉及术者技术、经验、体力以及与相关学科人员配合度。
复旦大学附属中山医院葛均波院士指出,失败的原因归根结底不外乎两大顽疾:一是不重视术前影像读片和对侧冠脉造影,二是术前冠脉CT和IVUS使用率不高。日本心脏介入专家玉井秀男曾多次告诫想征服CTO病变的介入医生:反复、仔细读片是成功基石!
葛均波多年经验总结认为,在认真、全面影像学读片和对侧冠脉造影基础上,适合正向介入治疗患者依病变特点顺序选用单一引导钢丝技术、平行引导钢丝技术,尽量经 IVUS 指导介入治疗;病变解剖结构提示前向技术成功率较低、存在可视侧支血管患者,应考虑逆向技术,如导引钢丝对吻技术、改良反向/反向CART技术、反向逆向/逆向导引钢丝捕获技术等。一旦出现冠脉穿孔、血液动力学不稳定、对比剂用量大、无法耐受手术或术者精疲力竭等情况,须立即中止介入干预。
3. 冠脉分叉病变:如何判定简单与复杂病变?
冠脉分叉病变指位于血管分叉部位、狭窄程度≥50%的病变,可同时或单独累及主支和重要分支血管。因斑块再分布、支架嵴移行等原因,处理主支血管病变同时常致邻近分支血管受累,对技术要求高、术后易发再狭窄,一直是介入治疗难点。ARTS Ⅱ等研究显示,分叉病变在多支血管病变中比例达 45%,超过 65% 左主干病变涉及左主干末端分叉。因此,科学干预分叉病变成为全球心血管介入医生的关注焦点,也是冠脉介入策略、操作技术的重要革新方向。
南京市第一医院陈绍良教授率先探索和创新推出的“双对吻挤压”(DK Crush)技术征服冠脉分叉病变并获国际同行认可,他认为术前介入医生务须明确七大要素:一是病变部位,二是分支血管直径(>2.5 mm),三是分叉角度,四是病变累及的心肌灌注区,五是分支血管闭塞概率,六是临床合并症,七是手术成功率。
不难看出,分叉病变分型是手术决策的重要依据,常用的Medina分型虽较为直观、易记忆,但无法全面、精确描述分叉病变的解剖学特性。为更精准制定手术策略,陈绍良对1561例患者行长期观察随访并提出区分简单、复杂分叉病变的便捷诊断体系,同时符合任一条主要指标和任两条次要指标提示复杂分叉病变(表1)。
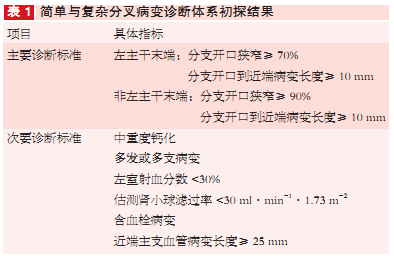
现有专家共识认为:必要时分支支架术对于大部分冠脉分叉病变来说是首选策略,尤其适用于简单分叉病变;复杂冠脉分叉病变优选双支支架术。
4. 指导冠脉介入治疗,IVUS、OCT、FFR 价值几何?
毋庸置疑,IVUS、光学相干断层成像(OCT)和FFR极大丰富了心血管介入医生对复杂或临界冠脉病变本质的理解,也为合理介入决策、精细处理靶病变提供依据。
IVUS、OCT属于腔内影像技术,相比冠脉造影的突出优势即能更清晰呈现局部血管或斑块,实时完成定性或定量评估。两者的最大区别在于分辨率,致使OCT对血管、斑块表面成像独具特点,IVUS则可穿透斑块、支架探查管壁重构状态。它们对于指导介入治疗有何价值,北京大学人民医院刘健教授指出,介入干预前,IVUS可精准测定血管直径、病变长度、斑块特征和周围解剖结构等,有助确定支架类型/型号、最佳释放位置和适宜的斑块去除方式;其后,它可获取最大支架横截面积、评估支架是否完全覆盖病变,识别、诊断和处理并发症。目前,几乎全部拟行介入治疗的左主干病变需IVUS从旁协助,至少半数非左主干病变同样离不开它的保驾。堪称“组织学显微镜”的OCT可通过探查斑块的纤维帽、脂核、钙化、微血管、胆固醇结晶、巨噬细胞分布、表面溃疡 / 破裂等告诉介入医生这是稳定性还是易损性斑块,能定性红色/白色血栓和展现支架覆盖表面内膜情况,术后还能帮助介入医生早期发现支架内内膜增生 / 破裂、新生内膜样斑块组织、血栓等新病变。OCT到底能否指导介入治疗,刘健认为仍需拭目以待。
FFR是通过导管测定冠脉压力、血流速度等生理指标的技术,不受血管直径、狭窄程度影响。检测前切记予腺苷、硝酸甘油等药物尽可能消除血管阻力因素,正常冠脉的FFR值是1;FFR<0.75,多提示冠脉狭窄病变有血液动力学意义,评判心肌缺血的特异性达 100%,推荐介入干预;FFR>0.80,常提示心肌缺血概率小,建议药物干预;0.75~0.80 为临界病变,需结合临床综合判断。浙江大学医学院附属第二医院王建安教授指出,FFR 能反映传感器下区域心肌供血,还可行微血管阻力测定,对 PCI 存在指导价值:明确心外膜下血管狭窄程度,界定心肌灌注面积,测定心肌血流量,诱导心肌缺血。但对于远端、连续性、弥漫性冠脉病变,FFR可能存误导隐患。
有学者提出,作为冠脉的功能性评价手段,FFR可以明确“要不要做”;相比冠脉造影,IVUS、OCT 等新兴影像学技术可为介入医生呈现更清晰、更细微的冠脉病变,主要解决“怎么做”。